Đặt vấn đề
Tại Việt Nam, số lượng các thuốc bảo vệ thực vật (BVTV) sinh học tăng nhanh nhưng doanh số chỉ đạt dưới 10% tổng doanh số thuốc BVTV (https://nongnghiep.vn/ 2020), trong khi đó lượng thuốc trừ sâu và trừ bệnh mỗi năm nước ta sử dụng vẫn rất lớn khoảng 16.400 tấn (https://danviet.vn/ 2018). Chính vì điều đó việc đẩy mạnh sản xuất và sử dụng thuốc BVTV sinh học nhằm dần thay thế các sản phẩm thuốc BVTV hóa học là rất cần thiết. Cùng với đó là việc kiểm soát chất lượng sản phẩm để tránh sản phẩm thuốc BVTV giả, kém chất lượng là công việc không kém phần quan trọng.
Bacillus thuringiensis (Bt) là vi khuẩn gram dương, có khả năng tạo bào tử, mang các gen cry mã hóa các protein tinh thể độc (protein cry) có hiệu quả phòng trừ đối với nhiều loại sâu bệnh hại trên cây trồng (Schnepf & cs., 1998). Do vậy vi khuẩn Bt đã và đang được ứng dụng rộng rãi trong việc sản xuất phân bón vi sinh. Chế phẩm sinh học đầu tiên có nguồn gốc từ các chủng Bt từ đó đến nay nó vẫn luôn là sản phẩm được sản xuất nhiều nhất và sử dụng phổ biến nhất.
Ở Việt Nam, chế phẩm Bt đã được nghiên cứu từ năm 1971. Tuy nhiên, các tiêu chuẩn cơ sở hay các tiêu chuẩn quốc gia đã ban hành không thể áp dụng để đánh giá định tính và định lượng vi khuẩn Bt trong phân bón vi sinh. Chính vì vậy, việc xây dựng được phương pháp để phát hiện và định lượng được vi khuẩn Bt trong các mẫu phân bón vi sinh trong điều kiện Việt Nam là cần thiết.
Kết quả và thảo luận
Phân lập các chủng vi khuẩn Bt giả định trong 6 chế phẩm sinh học
Để phân lập các chủng vi khuẩn Bt trong các chế phẩm sinh học, các mẫu chế phẩm được hoà tan trong môi trường LB lỏng được đệm bằng acetate 0,25M theo tỉ lệ 1:19 đến 1:99 tuỳ theo từng chế phẩm và ủ trong 5 phút ở 80°C nhằm diệt các tế bào sinh dưỡng và các tế bào không sinh bào tử. Sau đó mẫu thử được pha loãng đến nồng độ 10-4 và nuôi cấy 10 ml trên môi trường thạch LB ở 30°C trong 18-24h. Sau thời gian nuôi cấy, đếm các khuẩn lạc là các vi khuẩn Bt điển hình hoặc giả định nghi ngờ, gọi chung là khuẩn lạc giả định. Khuẩn lạc Bt điển hình trên môi trường LB là các khuẩn lạc có dạng hình tròn hoặc dẹt, màu trắng sữa, kích thước khuẩn lạc 1 mm – 7 mm. Sau đó các khuẩn lạc nghi ngờ là khuẩn lạc Bt được nuôi cấy trên môi trường thạch T3 ở nhiệt độ 30°C trong 48h. Các khuẩn lạc mọc trên môi trường T3 được quan sát hình thái khuẩn lạc và so sánh với chủng vi khuẩn Bt chuẩn (4T1).
Bảng 1. Kết quả phân lập và đặc điểm hình thái khuẩn lạc của 6 chủng khuẩn Bt phân lập từ 6 chế phẩm vi sinh trên môi trường T3
Định danh các chủng vi khuẩn Bt giả định thông qua hình thái và hóa sinh
Các khuẩn lạc mọc trên môi trường T3 sau đó được nhuộm soi quan sát hình dạng tế bào, bào tử, tinh thể và thử tính chất sinh hoá gồm phản ứng lecithinase, phản ứng catalase và phản ứng sucrose. Kết quả đặc điểm hình thái tế bào và thử tính chất sinh hoá được thể hiện ở bảng 2 và bảng 3.
Bảng 2. Đặc điểm hình thái tế bào của 6 chủng khuẩn Bt phân lập
Bảng 3. Kết quả thử nghiệm hóa sinh của của 6 chủng khuẩn Bt phân lập
Chú thích: (+): Dương tính , (-) Âm tính
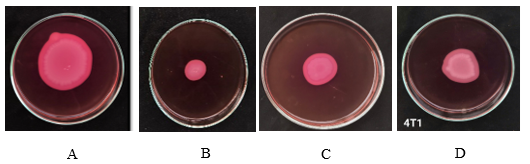
Hình 1. Kết quả thử nghiệm lecithinase. (A) chủng V, (B) chủng DT, (C) chủng S, (D) chủng chuẩn 4T1. Các khuẩn lạc Bt giả định trên môi trường T3 được nuôi cấy chấm khuẩn lạc trên môi trường thạch MYP và nuôi cấy ở 37°C trong 18-24h.
Hình 2. Kết quả thử nghiệm catalase. (A) chủng V, (B) chủng DT, (C) chủng S, (D) chủng chuẩn 4T1. Các khuẩn lạc Bt giả định trên môi trường T3 được chấm lên lam kính, sau đó nhỏ 2 giọt H2O2 3% phủ lên vi khuẩn và quan sát sự tạo thành bọt khí.

Hình 3. Kết quả thử nghiệm trên môi trường lên men sucrose. (A) Đối chứng âm, (B) chủng chuẩn 4T1 (C) chủng phân lập V. Lấy các khuẩn lạc mọc trên T3 cho vào dung dịch sucrose 10% vô trùng có bổ sung đỏ phenol và quan sát kết quả.
Xác định khả năng sinh tinh thể độc và bào tử của các chủng Bt giả định
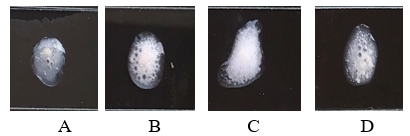
Để kiểm tra khả năng sinh tinh thể độc và khả năng sinh bào tử các khuẩn lạc trên môi trường T3 sau khi nuôi trong 48-72h được phết lên lam kính có chứa 1 giọt nước vô trùng sau đó khuấy đều và hơ trên đèn cồn đến khi khô. Sau đó, nhỏ 1-2 giọt dung dịch Coomassie brilliant blue, để trong 3 phút sau đó rửa sạch bằng nước cất và quan sát dưới kính hiển vi. Kết quả hình ảnh bào tử và tinh thể của các chủng được thể hiện ở bảng 4.
Bảng 4. Hình ảnh bào tử và tinh thể của một số chủng
Như vậy có thể thấy các chủng vi khuẩn Bt giả định phân lập từ các chế phẩm vi sinh có đặc điểm khuẩn lạc, đặc điểm tế bào, phản ứng hoá sinh, khả năng sinh bào tử và tinh thể tương đồng với chủng vi khuẩn Bt chuẩn. Đây cũng là những đặc điểm khác biệt đặc trưng của vi khuẩn Bt với các loài vi khuẩn khác có cùng hoạt tính hóa sinh trong chi Bacillus (Baumann và cs., 1984; Claus & Berkley, 1986; Slepecky & Hemphill, 1992; Carlson & Kolstø, 1993; Hansen và cs., 1998). Do vậy có thể bước đầu khẳng định các chủng vi khuẩn phân lập giả định là chủng vi khuẩn Bt.
Kiểm tra sự có mặt của các gen đặc hiệu cho vi khuẩn Bt ở các chủng phân lập bằng phương pháp PCR
Để khẳng định ở mức độ phân tử các chủng vi khuẩn phân lập là các chủng vi khuẩn Bt, chúng tôi kiểm tra sự có mặt của một số gen đặc trưng cho vi khuẩn Bt gồm gen GroEL, GyrB, XRE và gen Cry2 bằng phương pháp PCR (Chelliah và cs., 2019).
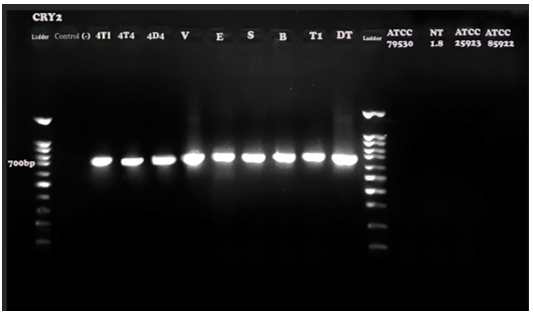
Hình 4. Kết quả điện di sản phẩm PCR với cặp mồi đặc hiệu cho gen Cry2 (kích thước đoạn băng đặc hiệu 700bp). Đối chứng âm là nước cất và các chủng ATCC79530 (Bacillus subtilis), NT 1.8 (B. amyloliquefaciens), ATCC 25923 (S. aureus ), ATCC 85922 (E.coli), đối chứng dương (chủng chuẩn): 4T1, 4T4, 4D4. Và các chủng phân lập là V, E, S, B, T1, DT. Thang chuẩn DNA 100bp.
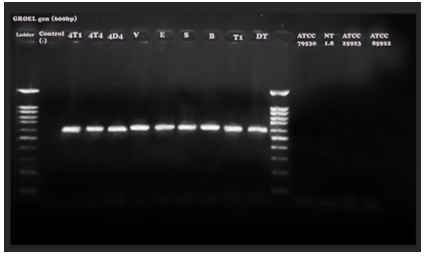
Hình 5. Kết quả điện di sản phẩm PCR với cặp mồi đặc hiệu cho gen GroEL (kích thước đoạn băng đặc hiệu 600bp).
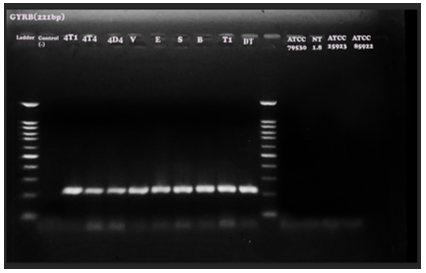
Hình 6. Kết quả điện di sản phẩm PCR với cặp mồi đặc hiệu cho gen Gryb (kích thước đoạn băng đặc hiệu 221bp).
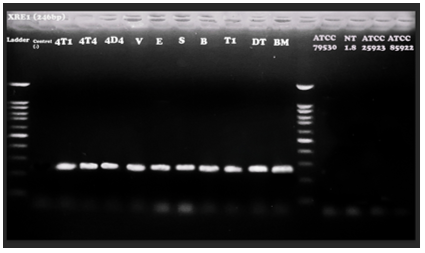
Hình 7. Kết quả điện di sản phẩm PCR với cặp mồi đặc hiệu cho gen XRE (kích thước đoạn băng đặc hiệu 246bp).
Kết quả phản ứng PCR với các cặp mồi đặc hiệu nhân bản các gen đặc trưng của vi khuẩn Bt cho thấy các chủng vi khuẩn phân lập giả định đều mang các vạch băng có kích thước bằng kích thước xuất hiện ở chủng vi khuẩn Bt chuẩn. Như vậy, kết hợp kết quả phân tích đặc điểm hình thái, sinh hoá và phân tích sự có mặt của các gen đặc trưng của vi khuẩn Bt bằng phương pháp PCR có thể khẳng định các chủng vi khuẩn phân lập là các chủng vi khuẩn Bt.
Tài liệu tham khảo
1. TCVN 12105:2018 Phân bón vi sinh vật - lấy mẫu.
2. TCVN 6404:2016 (ISO 7218:2007 with amendment 1:2013) Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Yêu cầu chung và hướng dẫn kiểm tra vi sinh vật.
3. TCCS 09: 2020/BVTV Thuốc bảo vệ thực vật - phương pháp xác định vi khuẩn Bacillus thuringiensis.
4. Tiêu chuẩn quốc gia TCVN 11133:2015 (ISO 22119:2011) về Vi sinh vật trong thực phẩm, thức ăn chăn nuôi - Phản ứng chuỗi polymerase real-time (pcr real-time) để phát hiện vi sinh vật gây bệnh từ thực phẩm - Định nghĩa và yêu cầu chung Vi sinh vật trong thực phẩm, thức ăn chăn nuôi. Phản ứng chuỗi polymerase real-time (pcr real-time) để phát hiện vi sinh vật gây bệnh từ thực phẩm.
5. TCVN 7682 (ISO 20838), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi – Phản ứng chuỗi polymeraza (PCR) để phát hiện sinh vật gây bệnh từ thực phẩm – Yêu cầu về khuếch đại và phát hiện đối với các phương pháp định tính.
6. ISO 22174, Microbiology of food and animal feeding stuffs – Polymerase chain reaction (PCR) for the detection of food-borne pathogens – General requirements and definitions (Vi sinh vật trong thực phẩm và thức ăn chăn nuôi – Phản ứng chuỗi trùng hợp để phát hiện sinh vật gây bệnh từ thực phẩm – Yêu cầu chung và định nghĩa).
7. Tiêu chuẩn quốc gia TCVN 10781:2015 (ISO/TS 13136:2012), vi sinh vật trong thực phẩm và thức ăn chăn nuôi – phương pháp phát hiện vi sinh vật gây bệnh trong thực phẩm bằng phản ứng chuỗi polymerase (PCR) thời gian thực – phát hiện escherichia coli sinh độc tố shiga (stec) và các định các nhóm huyết thanh O157, O111, O26, O103 và O145.
8. Alaeddino~lu FASaNG (1998) A rapid and simple method for staining of the crystal protein of Bacillus thuringiensis. Journal of Industrial Microbiology 3: 227-229.
9. Chang, Y.-H., Shangkuan, Y.-H., Lin, H.-C., & Liu, H.-W. (2003). PCR Assay of the groEL Gene for Detection and Differentiation of Bacillus cereus Group Cells. Applied and environmental microbiology, 69(8), 4502–4510.
10. Chelliah, R., Wei, S., Park, B. J., Rubab, M., Banan-Mwine Dalirii, E., Barathikannan, K., Jin, Y. G., & Oh, D. H. (2019). Whole genome sequence of Bacillus thuringiensis ATCC 10792 and improved discrimination of Bacillus thuringiensis from Bacillus cereus group based on novel biomarkers. Microbial Pathogenesis, 129, 284–297.
11.Dzieciol, M., Fricker, M., Wagner, M., Hein, I., & Ehling-Schulz, M. (2013). A novel diagnostic real-time PCR assay for quantification and differentiation of emetic and non-emetic Bacillus cereus. Food Control, 32(1), 176–185.
12.Rebecca LH, Zothansanga Singh BP, Gurusubramanian G, Senthil NK. DNA finger printing of Bacillus thuringiensis based on repetitive DNA sequences using ERIC-PCR. Sci Vis. 2011;11(3):147–154.
13. Travers RS, Martin PA, Reichelderfer CF (1987) Selective Process for Efficient Isolation of Soil Bacillus spp. Appl Environ Microbiol 53: 1263-6
14.Thiery I and Frachon E (1997). Bacteria: identification, isolation, culture and preservation of entomopathogenic bacteria. In Lawrence A Lacey. Manual of Techniques in Insect Pathology, Cap. III-1, Biological Techniques Series, Academic Press, London, p. 55-75.
TS. Ninh Thị Thảo1, TS. Nông Thị Huệ1, Phạm Văn Tuấn2, Nguyễn Thị Quỳnh Anh2, Đỗ Đức Mạnh2
1GVHD, 2Lớp K62CNSHE, Khoa CNSH
(Nguồn: https://vnua.edu.vn/)














